Premi Nobel 2017 – Chimica: osservare il mondo microscopico in HD3D
Il Konserthuset, la sala concerti di Stoccolma, è stato anche quest’anno teatro delle assegnazioni dei premi Nobel, avvenute tra il 2 e il 9 ottobre.
Il premio Nobel è un importante riconoscimento internazionale che si attribuisce a chi, nel mondo, contribuisce ad apportare i maggiori benefici all’umanità negli ambiti della medicina, chimica, fisica, letteratura e pace attraverso le proprie scoperte e invenzioni, opere letterarie e impegno sociale. È stato istituito per volontà di Alfred Nobel, un chimico e inventore; le premiazioni hanno avuto luogo per la prima volta nel 1901. Nel 1969 è stato creato anche il premio per l’economia.
Di particolare rilievo l’assegnazione del premio della Chimica a Jacques Dubochet (Svizzera 1942, Università di Losanna – nel suo curriculum afferma fieramente di essere dislessico), Joachim Frank (Germania 1940, Università di Columbia) e Richard Henderson (Scozia 1945, MRC Laboratorio di Biologia Molecolare di Cambridge) per “aver sviluppato il microscopio crio-elettronico, atto alla determinazione in alta risoluzione della struttura delle biomolecole in soluzione”.
Obiettivo della realizzazione della microscopia crio-elettronica è stato quello di superare l’ingrandimento ottenuto attraverso la normale microscopia elettronica, che utilizza un fascio di elettroni al posto della comune radiazione luminosa. Nella microscopia, la lunghezza d’onda della radiazione è proporzionale alle dimensioni osservabili, e il fascio di elettroni ha una lunghezza d’onda di gran lunga inferiore a quella della luce, così è possibile definire persino i singoli atomi.
Agli inizi però, la microscopia elettronica non poteva essere utilizzata con campioni biologici poiché con un fascio potente, questi si sarebbero inceneriti e con uno debole, le immagini sarebbero risultate confuse; era inoltre necessaria una condizione di vuoto in cui tuttavia le biomolecole si degradavano.
Richard Henderson, utilizzando una soluzione di glucosio e sfruttando la membrana cellulare sensibile alla luce, riuscì ad ottenere una prima immagine tridimensionale di una molecola biologica: la rodopsina; i due fattori hanno consentito la protezione della proteina dallo spazio vuoto e l’uso di un fascio di elettroni mediamente potente. Con gli anni ci fu un miglioramento della microscopia elettronica tale da ottenere la struttura della rodopsina, presentata da Henderson nel 1990.
La pecca, nell’utilizzo della soluzione di glucosio, fu l’impossibilità di osservare le molecole biologiche solubili in acqua. Altri ricercatori provarono così a congelare i campioni poiché il ghiaccio evapora più lentamente dell’acqua, ma in questo modo si provocava un’alterazione del fascio di elettroni che lo rendeva inutilizzabile.
Jacques Dubochet aveva trovato la soluzione già nel 1982, quando vetrificò delle goccioline di acqua in etano. La tecnica criogenica consisteva nel far raffreddare l’acqua così rapidamente da non consentire la formazione dei cristalli; in questo modo le molecole d’acqua rimanevano disordinate. Da quel momento si cimentò nello studio della vetrificazione dell’acqua sciogliendo prima dei campioncini biologici al suo interno. Nel 1984 Dubochet pubblicò le prime immagini di forme e strutture di vari virus, fra cui il virus Zika.
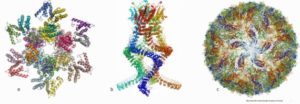
Con la risoluzione atomica, possiamo osservare nella foto seguente: a. il complesso proteico che regola i ritmi circadiani; b. la molecola che regola la percezione della pressione dell’aria e consente il corretto funzionamento dell’udito; c. il virus Zika
Joachim Frank nel frattempo cercava di ottenere immagini tridimensionali ad alta risoluzione da immagini bidimensionali a bassa risoluzione, ricavate dalla microscopia elettronica. Attraverso l’ideazione di un algoritmo matematico, il computer identificò schemi ricorrenti all’interno delle immagini rendendole alla fine più nitide. Nel 1991 Frank pubblicò le immagini tridimensionali dei ribosomi, ottenute con l’ausilio della tecnica di Debouchet, rendendo noto l’aspetto della loro superficie.
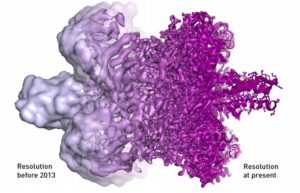
Con i miglioramenti apportati nel tempo, nel 2013 è stata finalmente ottenuta la risoluzione atomica. La differenza si può notare nella seguente rappresentazione dei ribosomi prima e dopo il 2013:
La microscopia crio-elettronica è una rivoluzione biochimica adesso disponibile nei laboratori di tutto il mondo: fondamentale per ottenere una visualizzazione tridimensionale a risoluzione atomica chiara e dettagliata, può essere utilizzata per l’osservazione di proteine o altri agglomerati molecolari e, in generale, delle relazioni fra le varie molecole nella matrice extracellulare. Inoltre, si possono ottenere le istantanee dei diversi processi chimici atomici che si svolgono in frazioni di miliardesimi di secondo.
Questa scoperta rappresenta una risorsa molto importante per la medicina e la farmacologia: attraverso l’osservazione delle proteine immunogene e dei virus, infatti, si potranno inventare nuovi vaccini e farmaci, con la conseguente cura di molte malattie.
Giorgia Di Bella 3B BS